Tělo jako laboratoř: skrytá pouť psilocybinu
Hlavní pozornost v souvislosti s psilocybinem jako psychedelickou látkou obsaženou v houbách rodu Psilocybe a jiných byla vždy orientována na její potenciál pozměnit vnímání po požití. Jakým způsobem působí na mozek, a to až na molekulární úrovni, a jaké vlastnosti má jím vyvolaný změněný stav vědomí. Co se však děje se samotnou látkou v organismu?
Jak se do něj dostává? Jakými chemickými přeměnami prochází? Kde všude se v těle vyskytuje? Jaké jsou hladiny v plazmě po podání? Jak je z těla následně vylučována? Je nebezpečné užívat psilocin v kombinaci s jinými látkami? Objasněním všech metabolických přeměn v průběhu pobytu v těle se zabývá farmakokinetické hodnocení. Od podání látky a její absorpci, přes metabolismus, distribuci v těle a následné vyloučení se posouváme do oblasti její skryté poutě, která je však esenciální součástí a spojovacím můstkem mezi požitím a tripem. Zvláště s ohledem na nedávnou renesanci klinického výzkumu těchto látek, jež jsou testovány v léčbě deprese rezistentní na dosavadní léčbu, obsedantně kompulzivní poruchy, migrén, závislosti na alkoholu či tabáku a v kontextu péče při terminálních onemocněních. V souvislosti s plánovanými a probíhajícími klinickými studiemi a očekávaným procesem schvalování regulačními orgány je nutné prokázat, že podávané dávky jsou bezpečné a že při nich nedochází k nežádoucím účinkům, a detailně popsat, jak se léčivo v těle mění a následně z něj vylučuje. Z terapeutického hlediska se jedná o nedocenitelné informace. Vydejme se tedy na opomíjenou, avšak zajímavou pouť laboratorními zákoutími našich těl.
Látky tělu cizí, tzv. xenobiotika, se do těla dostávají nejrůznějšími způsoby – požitím, vdechnutím či vstřebáním přes kůži. Ať už je ale cesta vstupu jakákoliv, vždycky je nutné překonat bariéru. Tuto bariéru tvoří epitely, což jsou povrchové vrstvy buněk oddělující vnější prostředí od vnitřního. Epitely sestávají z těsně spojených buněk, jejichž membrány zabraňují volnému průchodu látek. Pro určité látky existují v membránách speciální přenašeče, které vstup usnadňují. Ostatní látky přestupují přes membrány samovolně s různou úspěšností, a to podle jejich ochoty vstupovat do nepolárního lipidického prostředí membrány. Každá látka se totiž nachází někde v rozmezí kontinua hydrofilní–lipofilní, což je dáno nábojem chemických skupin v její struktuře. Čím více elektrického náboje na svém povrchu nese, tím polárnější je. Náboj vzniká z nerovnoměrného rozložení elektronů ve vazbě. Některé atomy jednoduše ve vazbě přitahují elektrony více, jiné méně. Příkladem polární skupiny může být hydroxylová skupina (OH), kde kyslík přitahuje elektrony více. Polární látky jsou hydrofilní (rozpouští se ve vodě) a méně ochotně vstupují do prostředí, která jsou nepolární, např. lipidy. Říkáme jim proto také látky lipofobní. Naopak je tomu u látek, které nemají polární charakter – nazýváme je lipofilní (či hydrofobní). Membrány jsou složeny z lipidů, proto přes ně snáze přechází látky, které jsou nepolární, lipofilní. Po požití podstupuje psilocybin první chemickou změnu – v kyselém prostředí žaludku a pomocí střevních enzymů zvaných alkalické fosfatázy (a další nespecifické esterázy) je rychle defosforylován, tj. zbaven fosfátové skupiny, na psilocin jako hlavní psychoaktivní látku. Díky vysoce polární fosfátové skupině je totiž psilocybin rozpustnější ve vodě než psilocin (obrázek 1).
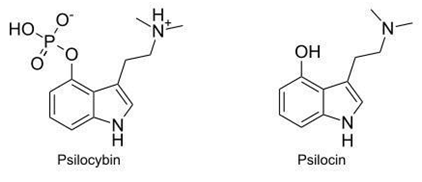
Psilocin je proto po orálním podání absorbován přes střevní epitel mnohem snadněji. Ve skutečnosti se předpokládá, že do systémového oběhu se vstřebává pouze psilocin a psilocybin funguje výlučně jako neaktivní, původní látka. Pro úplnou přeměnu psilocybinu na psilocin před vstupem do organismu svědčí dřívější pokusy, v nichž stejné množství psilocinu i psilocybinu vyvolalo identické psychotropní účinky u lidí. Neaktivní psilocybin tak musel být zcela přeměněn na psilocin. Zablokování funkce alkalických fosfatáz, jež tudíž znemožnilo přeměnu psilocybinu na psilocin, vedlo k jejich úplnému vymizení (1). V současné studii, ve které podali autoři 12 zdravým dobrovolníkům postupně se zvyšující perorální dávky psilocybinu 0,3, 0,45 a 0,6 mg/kg, byl podán přímější důkaz – v plazmě ani moči nebyl psilocybin vůbec detekován (2). Popsaným způsobem se dle dřívějších údajů ze studií se zvířaty vstřebá pouze 50 % perorálně podaného psilocybinu. Následně je téměř rovnoměrně roznesen cévním řečištěm do těla včetně mozku, kam se díky své hydrofobicitě snadno dostává přes bariéru oddělující cévy od mozkové tkáně (1). Detekovatelné množství psilocinu v plazmě se objevuje po 20–40 minutách, přičemž vrcholu dosahuje po 105–120 minutách. Následuje krátká fáze plateau trvající zhruba 50 minut. Zjistitelný je psilocin po dobu zhruba 6–8 hodin a látka z těla vymizí během 24 hodin (2,3).
Načrtnutý profil koncentrací, ale i skutečný časový průběh psychotropních účinků látky je však ovlivněn řadou faktorů. V klinických studiích je obvykle zajištěno, že účastníci požijí látku nalačno nebo s předem určenou snídaní, a to v dávce vypočítané z hmotnosti. Jenže v celé věci hraje dále roli množství faktorů jednotlivců, jako je jejich věk, tělesná kompozice, rasa, pohlaví, osobnostní dispozice, medikace, celková strava a genetický profil. Proto jsou mezi lidmi velké rozdíly, které ovlivňují, jak v organismu bude látka působit a jak na ni organismus odpoví (obrázek 2).
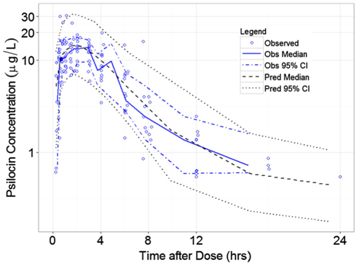
Co se však s psilocinem děje v průběhu jeho přítomnosti v těle (krom jeho zjevného psychotropního účinku)? Když se podíváme na obrázek 2, koncentrace psilocinu se postupně snižuje. Kterými cestami mizí a v jaké podobě? Každou látku se tělo snaží buď využít pro vlastní prospěch, nebo se jí co nejefektivněji co nejdříve zbavit. Každé xenobiotikum tak prochází řadou chemických přeměn, jejichž účelem je jeho následné vyloučení. Jednotlivé chemické reakce a enzymy, které je usnadňují, dohromady tvoří metabolickou dráhu. Jak se původní látka mění pomocí chemických reakcí, dochází k tvorbě chemicky pozměněných forem, tzv. metabolitů. Schopnost chemické přeměny má řada tkání, ale doslova specializovanou chemickou laboratoří jsou játra. Obecným cílem reakcí, které probíhají uvnitř jaterních buněk, je zvýšení rozpustnosti ve vodě – hydrofilnosti. Jak je uvedeno výše, hydrofilní látky jsou polární, což znamená, že nesou náboj. Proto jsou do molekuly zaneseny chemické skupiny, kde je rozložení elektronů nerovnoměrné a vzniká náboj. Kategoricky se dělí na dva typy reakcí. Prvním z nich je nejčastěji oxidace, při které jsou do molekuly vpraveny polární hydroxylové či karboxylové skupiny. První z nich se skládá z jednoho kyslíku a jednoho vodíku (OH), přičemž elektrony tíhnou ke kyslíku. Druhá pak z uhlíku, dvou atomů kyslíku a jednoho vodíku (COOH). I zde kyslíky přitahují elektrony k sobě a vytváří nerovnováhu, a vzniká tudíž malý náboj. Druhým pak konjugace s vysoce hydrofilní skupinou – např. glukuronidem, což je molekula bohatě obsypaná polárními hydroxylovými skupinami (OH). Při průchodu játry psilocin podstupuje oba typy reakcí do různé míry (1).
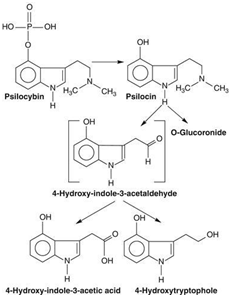
Pomocí enzymů zvaných monoaminooxidázy a aldehyddehydrogenázy dochází k demetylaci, tj. odstranění metylových skupin, a oxidativní deaminaci, tj. k odstranění aminoskupiny na postranním řetězci psilocinu (obrázek 1) a vpravení atomů kyslíku ke zvýšení polarity a hydrofilnosti. Psilocin tím ztrácí dvě nepolární metylové skupiny a aminoskupinu, jež jsou nahrazeny polární aldehydovou (COH), hydroxylovou (OH) a karboxylovou skupinou (COOH) (obrázek 3). Vznikají tak tři polární metabolity, z nichž hlavní je 4-hydroxyindol-3-octová kyselina (často zkracovaná jako 4-HIAA z anglického 4-hydroxy-indole-3-acetic acid). Všechny tyto metabolity jsou rovněž přítomné v krvi (1,3). Otázkou zůstává, zda si i po přeměně zachovají psychotropní účinek, jaké množství těchto látek z psilocinu vzniká a to, zda podstupují i další chemické změny.
Hlavním metabolitem u lidí je však molekula, která vzniká připojením kyseliny glukuronové přímo k psilocinu. Přestože zatím nejsou k dispozici přímé důkazy pro tento metabolit, tj. nikdo nepřistoupil k přímému stanovení, analýza moči jeho existenci prokázala. Po ošetření vzorků enzymem β-glukuronidázou, která štěpí vazbu mezi kyselinou glukuronovou a psilocinem, se uvolnilo obrovské množství psilocinu, a to až o 200 % vyšší než v původním, nezměněném vzorku moči. Při srovnání množství volného psilocinu a psilocinu vázaného s kyselinou glukuronovou vyšlo najevo, že až 80 % z celkově vyloučené látky se nachází ve formě psilocin-O-glukuronidu, kde „O“ značí vazbu psilocinu na glukuronid přes kyslík hydroxylové skupiny (OH) (obrázek 1) (4). K připojení kyseliny glukuronové dochází již pravděpodobně ve střevě, a to prostřednictvím enzymu UDP-glukuronosyltransferázy typu 1A10, avšak především se odehrává v játrech pomocí typu 1A9. Zajímavé je, že tyto enzymy se podílejí na přeměně značného množství látek s podobnou chemickou strukturou, jakou má psilocin, takže je otázkou, zda se nepodílí i na přeměně jiných metabolitů psilocinu (1).
Ačkoliv současná studie (2) hladiny metabolitů neměřila, autory navržený farmakokinetický model nejlépe odpovídá situaci, kdy je psilocin přítomen ve dvou kompartmentech. V rámci organismu představuje jeden kompartment ohraničený prostor oddělený od ostatních jasně rozlišitelným rozhraním. Je jím např. krevní řečiště, obsah žaludku, mozkomíšní mok apod. Když se zpětně podíváme na obrázek 2, vidíme dva vrcholy koncentrace. K tomu obvykle dochází tehdy, když je látka distribuována v těle ještě jinde než jen v krvi a dobře prokrvených orgánech, tj. v cévním kompartmentu, a to např. v tuku. Látka se po vstupu do organismu uvolní do krve a začne se hromadit i v jiném kompartmentu, např. v tuku. Poté, co koncentrace látky začne v krvi klesat, např. z důvodu vylučování, dochází k uvolňování látky z tuku, kde se usadila, zpět do prvního kompartmentu, jímž bylo cévní řečiště. Její hladina v krvi opět stoupá, neboť příliv z druhého kompartmentu převýší rychlost jejího vylučování, a lze pak pozorovat druhý vrchol její koncentrace v krvi v čase jako na obrázku 2. Psilocin se však pravděpodobně nehromadí v žádném strukturním, ohraničeném kompartmentu (jako např. v tuku), ale v „biochemickém“. V krvi totiž koluje zároveň ve značném množství ve formě, kdy je nepozměněný psilocin vázán na glukuronid. Vazbu mezi psilocinem a glukuronidem lze zpětně rozštěpit a slouží k tomu enzymy zvané β-glukuronidázy. Jsou přítomné v mnoha tkáních, avšak předpokládá se, že ke štěpení dochází v cévním řečišti. Výsledkem je okamžité zvýšení hladiny nezměněného psilocinu v krvi. Psilocin se tak pouze zpětně uvolňuje ze své biochemicky pozměněné podoby psilocin-O-glukuronidu (2).
Po zvýšení rozpustnosti ve vodě popsanými biotransformačními procesy jsou metabolity pravděpodobně vylučovány do žluče a do krve, odkud jsou v ledvinách filtrovány do moči. V nezměněné podobě jsou podle současné studie vylučovány pouze 2 % psilocinu (2), což je v souladu s dříve zjištěnými údaji na hladině 3,4 % (4). Zde svou pouť psilocybin v těle také končí.
Jedním z předpokladů klinického využití psilocybinu bude právě zhodnocení parametrů absorpce, distribuce, metabolismu a vylučování psilocinu a psilocybinu u lidí. Detailní znalosti o osudu psilocybinu v těle mají dalekosáhlé klinické dopady z hlediska určení dávky, bezpečnosti a kontraindikací. Současná studie využívala dávky přizpůsobené podle hmotnosti jedinců, jak je tomu obvyklé v souvislosti s psilocybinem. Avšak pro budoucí klinické účely jsou perorální dávky vztažené ke hmotnosti nepraktické. Farmakokinetický model, který bylo možné vytvořit na základě údajů od 12 dobrovolníků, umožnil provést simulace, jež prokázaly, že časový profil koncentrací psilocinu v plazmě při dávce 0,3 mg/kg odpovídá profilu fixní perorální dávky 25 mg (obrázek 2). U této dávky nebyl prokázán výskyt žádných závažných nežádoucích účinků, stejně jako tomu bylo u dalších dvou dávek v této studii (2) a u dalších farmakokinetických studií provedených na lidech (3,4). Mezi vedlejší účinky patřila mírná přechodná hypertenze, tachykardie a mírné bolesti hlavy (2), přičemž podrobně autoři slibují popsat v dalších článcích.
Z popsaných přeměn psilocinu a jeho metabolitů vyplývají další údaje, jež mohou mít vliv na výslednou koncentraci aktivní látky v plazmě. Jedná se především o zapojené enzymy. Nejenže mohou do hry vstupovat genetické polymorfizmy, což jsou drobné změny v genetickém kódu určitého genu jednotlivých lidí, jež mění jejich aktivitu, ale také látky ve stravě či ve spojitosti se životním stylem nebo jiné léky mohou způsobovat vzájemné interakce. Nejvíce se nabízí příklad inhibitorů monoaminooxidáz, jedné ze skupin antidepresiv, které by při současném požití snížily odbourávání psilocinu, a tím pravděpodobně zvýšily jeho dostupnost. Hrozí při tom riziko serotoninového syndromu, což je život ohrožující stav způsobený nadměrným zvýšením hladiny serotoninu. Nejde však jen o přímé chemické reakce, ale například i o stav fungování orgánů zajišťujících odbourání látky z krve.
Současná studie potvrdila, že aktivní látka (psilocin) v nezměněné podobě je ledvinami vylučována pouze v zanedbatelné míře. Pro pacienty se sníženou funkcí ledvin by proto užívání psilocybinu nemělo být nebezpečné, neboť jim nehrozí zvýšená hladina aktivního psilocinu (2). Jelikož byla studie provedena v souladu se zásadami Správné klinické praxe a Správné laboratorní praxe, jež jako soubor pravidel garantují úroveň výzkumu potřebnou pro schvalovací procesy, bude možné ji v budoucnu potenciálně využít ke schválení psilocybinu jako léku americkým Úřadem pro potraviny a léčiva (FDA).
Pavlína Nováková
Česká psychedelická společnost
Literatura
(1) DINIS-OLIVEIRA, Ricardo Jorge. Metabolism of psilocybin and psilocin: clinical and forensic toxicological relevance. Drug Metabolism Reviews [online]. 2016, 49(1), 84-91. DOI: 10.1080/03602532.2016.1278228. ISSN 0360-2532.
(2) BROWN, Randall T., Christopher R. NICHOLAS, Nicholas V. COZZI, et al. Pharmacokinetics of Escalating Doses of Oral Psilocybin in Healthy Adults. Clinical Pharmacokinetics [online]. DOI: 10.1007/s40262-017-0540-6. ISSN 0312-5963.
(3) HASLER, F., D. BOURQUIN, R. BRENNEISEN, T. BÄR a F.X. VOLLENWEIDER. Determination of psilocin and 4-hydroxyindole-3-acetic acid in plasma by HPLC-ECD and pharmacokinetic profiles of oral and intravenous psilocybin in man. Pharmaceutica Acta Helvetiae [online]. 1997, 72(3), 175-184. DOI: 10.1016/S0031-6865(97)00014-9. ISSN 00316865.
(4) HASLER, Felix, Daniel BOURQUIN, Rudolf BRENNEISEN a Franz X VOLLENWEIDER. Renal excretion profiles of psilocin following oral administration of psilocybin: a controlled study in man. Journal of Pharmaceutical and Biomedical Analysis [online]. 2002, 30(2), 331-339. DOI: 10.1016/S0731-7085(02)00278-9. ISSN 07317085.
Jak se do něj dostává? Jakými chemickými přeměnami prochází? Kde všude se v těle vyskytuje? Jaké jsou hladiny v plazmě po podání? Jak je z těla následně vylučována? Je nebezpečné užívat psilocin v kombinaci s jinými látkami? Objasněním všech metabolických přeměn v průběhu pobytu v těle se zabývá farmakokinetické hodnocení. Od podání látky a její absorpci, přes metabolismus, distribuci v těle a následné vyloučení se posouváme do oblasti její skryté poutě, která je však esenciální součástí a spojovacím můstkem mezi požitím a tripem. Zvláště s ohledem na nedávnou renesanci klinického výzkumu těchto látek, jež jsou testovány v léčbě deprese rezistentní na dosavadní léčbu, obsedantně kompulzivní poruchy, migrén, závislosti na alkoholu či tabáku a v kontextu péče při terminálních onemocněních. V souvislosti s plánovanými a probíhajícími klinickými studiemi a očekávaným procesem schvalování regulačními orgány je nutné prokázat, že podávané dávky jsou bezpečné a že při nich nedochází k nežádoucím účinkům, a detailně popsat, jak se léčivo v těle mění a následně z něj vylučuje. Z terapeutického hlediska se jedná o nedocenitelné informace. Vydejme se tedy na opomíjenou, avšak zajímavou pouť laboratorními zákoutími našich těl.
Látky tělu cizí, tzv. xenobiotika, se do těla dostávají nejrůznějšími způsoby – požitím, vdechnutím či vstřebáním přes kůži. Ať už je ale cesta vstupu jakákoliv, vždycky je nutné překonat bariéru. Tuto bariéru tvoří epitely, což jsou povrchové vrstvy buněk oddělující vnější prostředí od vnitřního. Epitely sestávají z těsně spojených buněk, jejichž membrány zabraňují volnému průchodu látek. Pro určité látky existují v membránách speciální přenašeče, které vstup usnadňují. Ostatní látky přestupují přes membrány samovolně s různou úspěšností, a to podle jejich ochoty vstupovat do nepolárního lipidického prostředí membrány. Každá látka se totiž nachází někde v rozmezí kontinua hydrofilní–lipofilní, což je dáno nábojem chemických skupin v její struktuře. Čím více elektrického náboje na svém povrchu nese, tím polárnější je. Náboj vzniká z nerovnoměrného rozložení elektronů ve vazbě. Některé atomy jednoduše ve vazbě přitahují elektrony více, jiné méně. Příkladem polární skupiny může být hydroxylová skupina (OH), kde kyslík přitahuje elektrony více. Polární látky jsou hydrofilní (rozpouští se ve vodě) a méně ochotně vstupují do prostředí, která jsou nepolární, např. lipidy. Říkáme jim proto také látky lipofobní. Naopak je tomu u látek, které nemají polární charakter – nazýváme je lipofilní (či hydrofobní). Membrány jsou složeny z lipidů, proto přes ně snáze přechází látky, které jsou nepolární, lipofilní. Po požití podstupuje psilocybin první chemickou změnu – v kyselém prostředí žaludku a pomocí střevních enzymů zvaných alkalické fosfatázy (a další nespecifické esterázy) je rychle defosforylován, tj. zbaven fosfátové skupiny, na psilocin jako hlavní psychoaktivní látku. Díky vysoce polární fosfátové skupině je totiž psilocybin rozpustnější ve vodě než psilocin (obrázek 1).

Obrázek 1: Struktura psilocybinu a psilocinu. Psilocybin je díky nabité fosfátové skupině rozpustnější ve vodě než psilocin, a prochází membránou tudíž méně ochotně. Zdroj: goo.gl/hxLbCx.
Psilocin je proto po orálním podání absorbován přes střevní epitel mnohem snadněji. Ve skutečnosti se předpokládá, že do systémového oběhu se vstřebává pouze psilocin a psilocybin funguje výlučně jako neaktivní, původní látka. Pro úplnou přeměnu psilocybinu na psilocin před vstupem do organismu svědčí dřívější pokusy, v nichž stejné množství psilocinu i psilocybinu vyvolalo identické psychotropní účinky u lidí. Neaktivní psilocybin tak musel být zcela přeměněn na psilocin. Zablokování funkce alkalických fosfatáz, jež tudíž znemožnilo přeměnu psilocybinu na psilocin, vedlo k jejich úplnému vymizení (1). V současné studii, ve které podali autoři 12 zdravým dobrovolníkům postupně se zvyšující perorální dávky psilocybinu 0,3, 0,45 a 0,6 mg/kg, byl podán přímější důkaz – v plazmě ani moči nebyl psilocybin vůbec detekován (2). Popsaným způsobem se dle dřívějších údajů ze studií se zvířaty vstřebá pouze 50 % perorálně podaného psilocybinu. Následně je téměř rovnoměrně roznesen cévním řečištěm do těla včetně mozku, kam se díky své hydrofobicitě snadno dostává přes bariéru oddělující cévy od mozkové tkáně (1). Detekovatelné množství psilocinu v plazmě se objevuje po 20–40 minutách, přičemž vrcholu dosahuje po 105–120 minutách. Následuje krátká fáze plateau trvající zhruba 50 minut. Zjistitelný je psilocin po dobu zhruba 6–8 hodin a látka z těla vymizí během 24 hodin (2,3).
Načrtnutý profil koncentrací, ale i skutečný časový průběh psychotropních účinků látky je však ovlivněn řadou faktorů. V klinických studiích je obvykle zajištěno, že účastníci požijí látku nalačno nebo s předem určenou snídaní, a to v dávce vypočítané z hmotnosti. Jenže v celé věci hraje dále roli množství faktorů jednotlivců, jako je jejich věk, tělesná kompozice, rasa, pohlaví, osobnostní dispozice, medikace, celková strava a genetický profil. Proto jsou mezi lidmi velké rozdíly, které ovlivňují, jak v organismu bude látka působit a jak na ni organismus odpoví (obrázek 2).

Obrázek 2: Časový profil koncentrace psilocinu v plazmě po podání dávky 0, 3 mg/kg. Modrá plná čára představuje medián koncentrací od všech 12 subjektů ve skupině. Přerušovaná modrá čára představuje 95% intervaly spolehlivosti. Jednotlivé modré kroužky představují měření v různých časových bodech od každého subjektu. Přerušovaná černá čára tvoří medián koncentrací vyplývajících ze simulace fixní perorální dávky 25 mg. Tečkovaná černá čára pak 95% intervaly spolehlivosti. Převzato z citace 2.
Co se však s psilocinem děje v průběhu jeho přítomnosti v těle (krom jeho zjevného psychotropního účinku)? Když se podíváme na obrázek 2, koncentrace psilocinu se postupně snižuje. Kterými cestami mizí a v jaké podobě? Každou látku se tělo snaží buď využít pro vlastní prospěch, nebo se jí co nejefektivněji co nejdříve zbavit. Každé xenobiotikum tak prochází řadou chemických přeměn, jejichž účelem je jeho následné vyloučení. Jednotlivé chemické reakce a enzymy, které je usnadňují, dohromady tvoří metabolickou dráhu. Jak se původní látka mění pomocí chemických reakcí, dochází k tvorbě chemicky pozměněných forem, tzv. metabolitů. Schopnost chemické přeměny má řada tkání, ale doslova specializovanou chemickou laboratoří jsou játra. Obecným cílem reakcí, které probíhají uvnitř jaterních buněk, je zvýšení rozpustnosti ve vodě – hydrofilnosti. Jak je uvedeno výše, hydrofilní látky jsou polární, což znamená, že nesou náboj. Proto jsou do molekuly zaneseny chemické skupiny, kde je rozložení elektronů nerovnoměrné a vzniká náboj. Kategoricky se dělí na dva typy reakcí. Prvním z nich je nejčastěji oxidace, při které jsou do molekuly vpraveny polární hydroxylové či karboxylové skupiny. První z nich se skládá z jednoho kyslíku a jednoho vodíku (OH), přičemž elektrony tíhnou ke kyslíku. Druhá pak z uhlíku, dvou atomů kyslíku a jednoho vodíku (COOH). I zde kyslíky přitahují elektrony k sobě a vytváří nerovnováhu, a vzniká tudíž malý náboj. Druhým pak konjugace s vysoce hydrofilní skupinou – např. glukuronidem, což je molekula bohatě obsypaná polárními hydroxylovými skupinami (OH). Při průchodu játry psilocin podstupuje oba typy reakcí do různé míry (1).
Pomocí enzymů zvaných monoaminooxidázy a aldehyddehydrogenázy dochází k demetylaci, tj. odstranění metylových skupin, a oxidativní deaminaci, tj. k odstranění aminoskupiny na postranním řetězci psilocinu (obrázek 1) a vpravení atomů kyslíku ke zvýšení polarity a hydrofilnosti. Psilocin tím ztrácí dvě nepolární metylové skupiny a aminoskupinu, jež jsou nahrazeny polární aldehydovou (COH), hydroxylovou (OH) a karboxylovou skupinou (COOH) (obrázek 3). Vznikají tak tři polární metabolity, z nichž hlavní je 4-hydroxyindol-3-octová kyselina (často zkracovaná jako 4-HIAA z anglického 4-hydroxy-indole-3-acetic acid). Všechny tyto metabolity jsou rovněž přítomné v krvi (1,3). Otázkou zůstává, zda si i po přeměně zachovají psychotropní účinek, jaké množství těchto látek z psilocinu vzniká a to, zda podstupují i další chemické změny.
Hlavním metabolitem u lidí je však molekula, která vzniká připojením kyseliny glukuronové přímo k psilocinu. Přestože zatím nejsou k dispozici přímé důkazy pro tento metabolit, tj. nikdo nepřistoupil k přímému stanovení, analýza moči jeho existenci prokázala. Po ošetření vzorků enzymem β-glukuronidázou, která štěpí vazbu mezi kyselinou glukuronovou a psilocinem, se uvolnilo obrovské množství psilocinu, a to až o 200 % vyšší než v původním, nezměněném vzorku moči. Při srovnání množství volného psilocinu a psilocinu vázaného s kyselinou glukuronovou vyšlo najevo, že až 80 % z celkově vyloučené látky se nachází ve formě psilocin-O-glukuronidu, kde „O“ značí vazbu psilocinu na glukuronid přes kyslík hydroxylové skupiny (OH) (obrázek 1) (4). K připojení kyseliny glukuronové dochází již pravděpodobně ve střevě, a to prostřednictvím enzymu UDP-glukuronosyltransferázy typu 1A10, avšak především se odehrává v játrech pomocí typu 1A9. Zajímavé je, že tyto enzymy se podílejí na přeměně značného množství látek s podobnou chemickou strukturou, jakou má psilocin, takže je otázkou, zda se nepodílí i na přeměně jiných metabolitů psilocinu (1).

Obrázek 3: Metabolismus psilocybinu a psilocinu. Psilocin podstupuje demetylaci a oxidativní deaminaci na 4-hydroxyindol-3-octovou kyselinu a 4-hydroxytryptofol. Hlavním metabolitem u lidí je však psilocin-O-glukuronid. Zdroj: goo.gl/9hmPqk.
Ačkoliv současná studie (2) hladiny metabolitů neměřila, autory navržený farmakokinetický model nejlépe odpovídá situaci, kdy je psilocin přítomen ve dvou kompartmentech. V rámci organismu představuje jeden kompartment ohraničený prostor oddělený od ostatních jasně rozlišitelným rozhraním. Je jím např. krevní řečiště, obsah žaludku, mozkomíšní mok apod. Když se zpětně podíváme na obrázek 2, vidíme dva vrcholy koncentrace. K tomu obvykle dochází tehdy, když je látka distribuována v těle ještě jinde než jen v krvi a dobře prokrvených orgánech, tj. v cévním kompartmentu, a to např. v tuku. Látka se po vstupu do organismu uvolní do krve a začne se hromadit i v jiném kompartmentu, např. v tuku. Poté, co koncentrace látky začne v krvi klesat, např. z důvodu vylučování, dochází k uvolňování látky z tuku, kde se usadila, zpět do prvního kompartmentu, jímž bylo cévní řečiště. Její hladina v krvi opět stoupá, neboť příliv z druhého kompartmentu převýší rychlost jejího vylučování, a lze pak pozorovat druhý vrchol její koncentrace v krvi v čase jako na obrázku 2. Psilocin se však pravděpodobně nehromadí v žádném strukturním, ohraničeném kompartmentu (jako např. v tuku), ale v „biochemickém“. V krvi totiž koluje zároveň ve značném množství ve formě, kdy je nepozměněný psilocin vázán na glukuronid. Vazbu mezi psilocinem a glukuronidem lze zpětně rozštěpit a slouží k tomu enzymy zvané β-glukuronidázy. Jsou přítomné v mnoha tkáních, avšak předpokládá se, že ke štěpení dochází v cévním řečišti. Výsledkem je okamžité zvýšení hladiny nezměněného psilocinu v krvi. Psilocin se tak pouze zpětně uvolňuje ze své biochemicky pozměněné podoby psilocin-O-glukuronidu (2).
Po zvýšení rozpustnosti ve vodě popsanými biotransformačními procesy jsou metabolity pravděpodobně vylučovány do žluče a do krve, odkud jsou v ledvinách filtrovány do moči. V nezměněné podobě jsou podle současné studie vylučovány pouze 2 % psilocinu (2), což je v souladu s dříve zjištěnými údaji na hladině 3,4 % (4). Zde svou pouť psilocybin v těle také končí.
Jedním z předpokladů klinického využití psilocybinu bude právě zhodnocení parametrů absorpce, distribuce, metabolismu a vylučování psilocinu a psilocybinu u lidí. Detailní znalosti o osudu psilocybinu v těle mají dalekosáhlé klinické dopady z hlediska určení dávky, bezpečnosti a kontraindikací. Současná studie využívala dávky přizpůsobené podle hmotnosti jedinců, jak je tomu obvyklé v souvislosti s psilocybinem. Avšak pro budoucí klinické účely jsou perorální dávky vztažené ke hmotnosti nepraktické. Farmakokinetický model, který bylo možné vytvořit na základě údajů od 12 dobrovolníků, umožnil provést simulace, jež prokázaly, že časový profil koncentrací psilocinu v plazmě při dávce 0,3 mg/kg odpovídá profilu fixní perorální dávky 25 mg (obrázek 2). U této dávky nebyl prokázán výskyt žádných závažných nežádoucích účinků, stejně jako tomu bylo u dalších dvou dávek v této studii (2) a u dalších farmakokinetických studií provedených na lidech (3,4). Mezi vedlejší účinky patřila mírná přechodná hypertenze, tachykardie a mírné bolesti hlavy (2), přičemž podrobně autoři slibují popsat v dalších článcích.
Z popsaných přeměn psilocinu a jeho metabolitů vyplývají další údaje, jež mohou mít vliv na výslednou koncentraci aktivní látky v plazmě. Jedná se především o zapojené enzymy. Nejenže mohou do hry vstupovat genetické polymorfizmy, což jsou drobné změny v genetickém kódu určitého genu jednotlivých lidí, jež mění jejich aktivitu, ale také látky ve stravě či ve spojitosti se životním stylem nebo jiné léky mohou způsobovat vzájemné interakce. Nejvíce se nabízí příklad inhibitorů monoaminooxidáz, jedné ze skupin antidepresiv, které by při současném požití snížily odbourávání psilocinu, a tím pravděpodobně zvýšily jeho dostupnost. Hrozí při tom riziko serotoninového syndromu, což je život ohrožující stav způsobený nadměrným zvýšením hladiny serotoninu. Nejde však jen o přímé chemické reakce, ale například i o stav fungování orgánů zajišťujících odbourání látky z krve.
Současná studie potvrdila, že aktivní látka (psilocin) v nezměněné podobě je ledvinami vylučována pouze v zanedbatelné míře. Pro pacienty se sníženou funkcí ledvin by proto užívání psilocybinu nemělo být nebezpečné, neboť jim nehrozí zvýšená hladina aktivního psilocinu (2). Jelikož byla studie provedena v souladu se zásadami Správné klinické praxe a Správné laboratorní praxe, jež jako soubor pravidel garantují úroveň výzkumu potřebnou pro schvalovací procesy, bude možné ji v budoucnu potenciálně využít ke schválení psilocybinu jako léku americkým Úřadem pro potraviny a léčiva (FDA).
Pavlína Nováková
Česká psychedelická společnost
Literatura
(1) DINIS-OLIVEIRA, Ricardo Jorge. Metabolism of psilocybin and psilocin: clinical and forensic toxicological relevance. Drug Metabolism Reviews [online]. 2016, 49(1), 84-91. DOI: 10.1080/03602532.2016.1278228. ISSN 0360-2532.
(2) BROWN, Randall T., Christopher R. NICHOLAS, Nicholas V. COZZI, et al. Pharmacokinetics of Escalating Doses of Oral Psilocybin in Healthy Adults. Clinical Pharmacokinetics [online]. DOI: 10.1007/s40262-017-0540-6. ISSN 0312-5963.
(3) HASLER, F., D. BOURQUIN, R. BRENNEISEN, T. BÄR a F.X. VOLLENWEIDER. Determination of psilocin and 4-hydroxyindole-3-acetic acid in plasma by HPLC-ECD and pharmacokinetic profiles of oral and intravenous psilocybin in man. Pharmaceutica Acta Helvetiae [online]. 1997, 72(3), 175-184. DOI: 10.1016/S0031-6865(97)00014-9. ISSN 00316865.
(4) HASLER, Felix, Daniel BOURQUIN, Rudolf BRENNEISEN a Franz X VOLLENWEIDER. Renal excretion profiles of psilocin following oral administration of psilocybin: a controlled study in man. Journal of Pharmaceutical and Biomedical Analysis [online]. 2002, 30(2), 331-339. DOI: 10.1016/S0731-7085(02)00278-9. ISSN 07317085.

 Deník dobrovolníka: Vítej, český bratře! Ukrajinci děkovali za pomoc na každém kroku
Deník dobrovolníka: Vítej, český bratře! Ukrajinci děkovali za pomoc na každém kroku Laskavý duchovní i tvrdý politik. Františkův pontifikát se uzavřel bez revoluce
Laskavý duchovní i tvrdý politik. Františkův pontifikát se uzavřel bez revoluce Konečně! Trumpův mírový plán pro Ukrajinu je zde
Konečně! Trumpův mírový plán pro Ukrajinu je zde Anglický deník: Krysí kalamita? Místní si o to koledovali
Anglický deník: Krysí kalamita? Místní si o to koledovali Odešel renesanční psychiatr Cyril Höschl
Odešel renesanční psychiatr Cyril Höschl

