Psilocybin – nová naděje v léčbě depresí nereagujících na standardní léčbu
Komentář k publikaci: Carhart-Harris, R. L. et al. 2016. „Psilocybin with psychological support for treatment-resistant depression: an open-label feasibility study“ Lancet Psychiatry 2016. Publikováno online 17. května 2016: http://dx.doi.org/10.1016/S2215-0366(16)30065-7
Psilocybin je přírodní alkaloid nacházející se v houbách rodu Psilocybe, známých jako lysohlávky. Tyto psychoaktivní houby byly po tisíce let využívány v spirituálním a léčebném kontextu v mnoha starobylých kulturách: šamanské využití psychoaktivních hub znázorňují již jeskynní malby z Tassili n'Ajjer v Severní Africe z období mezolitu [1]. Známé je především užívání psilocybinových hub kulturami Střední Ameriky z dob před objevením kontinentu Kryštofem Kolumbem. Bernardino de Sahagún v 16. století popsal rituální používání psilocybinových hub Aztéky, kteří je nazývali teonanácatl („maso bohů“) [2]. Pro moderní západní společnost a vědu byly psilocybinové houby takřka neznámé až do roku 1955, kdy se bankéř a amatérský mykolog R. Gordon Wasson jako první „bílý muž“ aktivně zúčastnil houbové ceremonie vedené mazatéckou šamankou Marií Sabinou. o svůj mimořádný zážitek se podělil v časopise Life v roce 1957 [3]. Albert Hoffmann, objevitel LSD, z těchto hub následně jako první izoloval psilocin a psilocybin, látky zodpovědné za psychoaktivní účinek [4].
Psilocybin patří mezi klasická psychedelika, v mozku tedy působí jako agonista serotoninových receptorů (5-HT2A) [5]. Agonismus těchto receptorů byl ve studiích na zvířatech spojen s rozšířením kognitivní flexibility [6], asociativním učením [7], kortikální neuronální plasticitou [8], neurogenezí (vznikem nových neuronů) [9] a antidepresivní odpovědí [10]. Nedávné klinické studie s psilocybinem na lidských subjektech přinesly velmi slibné předběžné výsledky v léčbě úzkosti u pacientů v terminálním stádiu rakoviny [11], obsedantně-kompulzivní poruchy [12] či závislostí [13, 14].
V posledních týdnech vyvolaly ve světových médiích rozruch výsledky aktuálního výzkumu britského týmu pod vedením neurovědce Dr. Robina Carharta-Harrise z Imperial College London. Tyto výsledky naznačují, že by psilocybin mohl představovat účinnou léčbu farmakorezistentních depresivních onemocnění, které na standardní léčbu nereagují [15]. Studie se zúčastnilo 12 pacientů, kteří trpěli středně těžkou až těžkou depresivní poruchou v průměru 17,8 let svého života. V tomto období podstoupili více neúspěšných léčebných zákroků, každý z nich vyzkoušel různé skupiny antidepresiv a s výjimkou jednoho subjektu i léčbu psychoterapií.
V rámci studie podstoupili pacienti dvě sezení s psilocybinem v podpůrném prostředí: s úvodní bezpečnostní (nízkou) dávkou 10 mg a následnou terapeutickou (vysokou) dávkou 25 mg v sedmidenním rozestupu. Sezením s psilocybinem předcházelo psychiatrické interview, vstupní měření baterií psychologických testů, měření pomocí funkční magnetické rezonance (fMRI) a přípravné psychologické sezení. v průběhu tohoto přípravného sezení byly pokusné osoby požádány, aby otevřeně mluvily o své osobní historii (včetně vlastních úvah o příčinách jejich deprese). Následně s nimi byly prodiskutovány možné psychologické účinky psilocybinu a proběhla simulace prvků sezení s aktivní látkou, jako například poslech ukázek hudby používané v sezeních s klapkami na očích.
Samotná sezení s psilocybinem probíhala v upravené místnosti s tlumeným světlem za neustále přítomnosti dvou asistentů, tzv. sitterů. Pacienti byli požádáni, aby se uvolnili na lůžku v poloze na zádech za doprovodu hudby přehrávané přes reproduktory a sluchátka. Sitteři se nacházeli po obou stranách lůžka a aplikovali nedirektivní podpůrný přístup, umožňující pacientům zažívat co nejvíce nerušenou „vnitřní cestu“.
Den po druhém psilocybinovém sezení následovalo opětovné měření psychologickými dotazníky a zobrazovací vyšetření mozku pomocí fMRI. Další opakovaná měření dotazníky se uskutečnila po 1, 2, 3 a 5 týdnech a poslední po 3 měsících od podání druhé dávky.
Akutní účinek psilocybinu byl dobře tolerovaný veškerými 12 pacienty a nevyskytly se žádné závažné nebo neočekávané vedlejší účinky. Nejčastějším vedlejším účinkem byla přechodná úzkost (většinou mírná) v období začátku působení účinku látky, kterou zažili všichni pacienti. Mezi další vedlejší účinky patřila přechodná zmatení a poruchy myšlení (9 pacientů), mírná nevolnost (4 pacienti) a přechodná bolest hlavy (4 pacienti). Všechny popsané dočasné projevy byly očekávanými účinky psilocybinu. Paranoidní prožívání se vyskytlo jenom u jednoho pacienta a bylo mírné a přechodné. Žádné trvalé psychotické příznaky nebyly pozorovány ani u jednoho z pacientů.
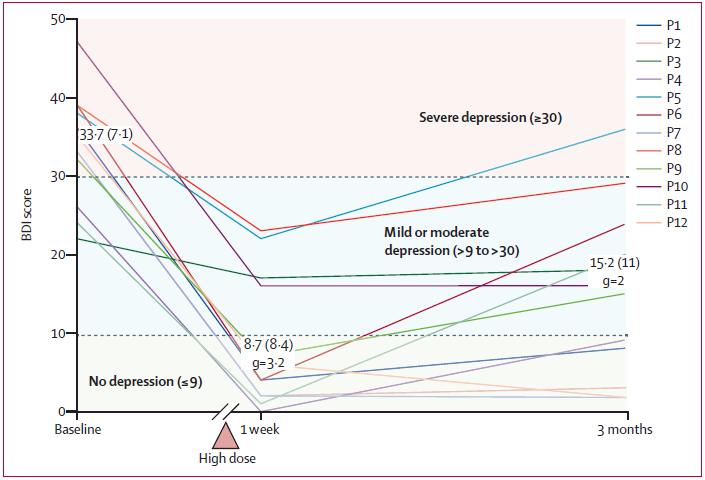
Po sezeních s psilocybinem nastalo u všech pacientů významné snížení příznaků deprese. Dle standardních posuzovacích kritérií týden po druhé dávce psilocybinu dosahovalo osm (67 %) z 12 pacientů plnou remisi (stav zcela bez deprese) a 3 měsíce od psychedelického sezení plnilo kritérium pro odpověď na léčbu (50% snížení skóre v Beckově škále deprese – BDI, v porovnání se vstupními hodnotami) stále sedm pacientů (58 %), z toho pět (42 %) stále zůstávalo v plné remisi. v porovnání se vstupními měřeními došlo u pacientů i k významnému poklesu úzkostlivosti (škála STAI-T) a anhedonie (škála SHAPS), přičemž rozdíly byly stále významné i 3 měsíce od druhé dávky psilocybinu.
Výsledky této studie poukázaly na to, že při dodržení náležitých postupů (pečlivý screening a adekvátní terapeutická podpora) je možné psilocybin bezpečně podat skupině pacientů s depresí. Rozsah a trvání snížení závažnosti symptomatiky podporuje legitimitu dalšího kontrolovaného výzkumu psilocybinu v léčbě deprese. Autoři jsou si vědomí limitů této pilotní studie vyplývajících z nízkého počtu subjektů a metodologického designu studie bez využití kontrolní skupiny (placebo) a dvojitě zaslepeného uspořádání. Klíčové otázky, na které by se podle výzkumníků měl další výzkum zaměřit, je vysvětlit, proč je pozorovaný terapeutický efekt tak velký a zda ho bude možné replikovat v metodologicky přísněji kontrolovaných studiích na větších vzorcích populace. Tato léčebná procedura se totiž neskládala pouze ze dvou dávek psilocybinu ale také z psychologické podpory před, v průběhu a následně po psychedelických sezeních. Tento vliv pozitivního terapeutického prostředí je v budoucích studiích nutno detailněji prozkoumat a kontrolovat.
Graf zveřejněný v rámci studie, který znázorňuje závažnost deprese (dle škály BDI) v čase u všech 12 jednotlivých pacientů, ukazuje další skutečnost, kterou však autoři studie v textu nezmiňují: příznaky deprese v průběhu 3měsíčního období po podaní druhé dávky psilocybinu u více než poloviny subjektů opětovně pozvolna narůstaly. Zdá se, že u těchto pacientů by bylo třeba dávku po 3 měsících opakovat. Navzdory tomu by však šlo o významný pokrok v léčbě v porovnání s každodenním užíváním antidepresiv, jejichž účinek se navíc dostavuje až po několika týdnech užívání (a například u těchto pacientů se dokonce nedostavil vůbec). Vzhledem k tomu, že po psychedelických sezeních nenásledovala žádná kontinuální psychoterapie, která by se zaměřovala na hlubší osobnostní změnu pacientů, bylo by možné pozvolný opětovný nárůst příznaků vysvětlit i opakováním nezpracovaných nevědomých vzorců fungování, které vedou k rozvoji deprese. Z tohoto důvodu by bylo zajímavé zaměřit se v dalších výzkumech na podání psilocybinu v kontextu dlouhodobější psychoterapie, která by mohla využít období dočasně zvýšené neuroplasticity po užití psilocybinu na dosažení hlubších osobnostních změn.
Jaroslav Farkaš
Česká psychedelická společnost
Jazyková korektura: Vojtěch Viktorin, Jan Tichý
Zdroje:
1. Samorini, G. The oldest representations of hallucinogenic mushrooms in the world (Sahara Desert, 9000–7000 B.P.). Integration 1992; 2 (3): 69–78.
2. Hofmann A. Teonanácatl and Ololiuqui, two ancient magic drugs of Mexico. Bulletin on Narcotics 1971; 1: 3-14.
3. Wasson RG. Seeking the magic mushroom. Life 1957; May 13: 100–120.
4. Hofmann A, Frey A, Ott H, Petrzilka T, Troxler F. Konstitutionsaufklärung und Synthese von Psilocybin [The composition and synthesis of psilocybin]. Cellular and Molecular Life Sciences (in German) 1958; 14 (11): 397–399.
5. Tylš F. Neurobiologie psilocybinu ve vztahu k jeho potenciálnímu terapeutickému využití. Psychiatrie 2015; 19 (2): 104-112.
6. Boulougouris V, Glennon JC, Robbins TW. Dissociable effects of selective 5-HT2A and 5-HT2C receptor antagonists on serial spatial reversal learning in rats. Neuropsychopharmacology 2008; 33: 2007–19.
7. Harvey JA. Role of the serotonin 5-HT(2A) receptor in learning. Learn Mem 2003; 10: 355–62.
8. Vaidya VA, Marek GJ, Aghajanian GK, Duman RS. 5-HT2A receptor-mediated regulation of brain-derived neurotrophic factor mRNA in the hippocampus and the neocortex. J Neurosci 1997; 17 (8): 2785–95.
9. Catlow BJ, Song S, Paredes DA, Kirstein CL, Sanchez-Ramos J. Effects of psilocybin on hippocampal neurogenesis and extinction of trace fear conditioning. Exp Brain Res 2013; 228: 481-491.
10. Buchborn T, Schroder H, Hollt V, Grecksch G. Repeated lysergic acid diethylamide in an animal model of depression: normalisation of learning behaviour and hippocampal serotonin 5-HT2 signalling. J Psychopharmacol 2014; 28: 545–52.
11. Grob CS, Danforth AL, Chopra GS, et al. Pilot study of psilocybin treatment for anxiety in patients with advanced-stage cancer. Arch Gen Psychiatry 2011; 68: 71–78.
12. Moreno FA, Wiegand CB, Taitano EK, Delgado PL. Safety, tolerability, and efficacy of psilocybin in 9 patients with obsessive-compulsive disorder. J Clin Psychiatry 2006; 67: 1735–40.
13. Johnson MW, Garcia-Romeu A, Cosimano MP, Griffiths RR. Pilot study of the 5-HT2AR agonist psilocybin in the treatment of tobacco addiction. J Psychopharmacol 2014; 28: 983–92.
14. Bogenschutz MP, Forcehimes AA, Pommy JA, Wilcox CE, Barbosa P, Strassman RJ. Psilocybin-assisted treatment for alcohol dependence: a proof-of-concept study. J Psychopharmacol 2015; 29: 289–99.
15. Carhart-Harris, RL et al. Psilocybin with psychological support for treatment-resistant depression: an open-label feasibility study. Lancet Psychiatry 2016; Publikováno online 17. května 2016: http://dx.doi.org/10.1016/S2215-0366(16)30065-7.
Psilocybin je přírodní alkaloid nacházející se v houbách rodu Psilocybe, známých jako lysohlávky. Tyto psychoaktivní houby byly po tisíce let využívány v spirituálním a léčebném kontextu v mnoha starobylých kulturách: šamanské využití psychoaktivních hub znázorňují již jeskynní malby z Tassili n'Ajjer v Severní Africe z období mezolitu [1]. Známé je především užívání psilocybinových hub kulturami Střední Ameriky z dob před objevením kontinentu Kryštofem Kolumbem. Bernardino de Sahagún v 16. století popsal rituální používání psilocybinových hub Aztéky, kteří je nazývali teonanácatl („maso bohů“) [2]. Pro moderní západní společnost a vědu byly psilocybinové houby takřka neznámé až do roku 1955, kdy se bankéř a amatérský mykolog R. Gordon Wasson jako první „bílý muž“ aktivně zúčastnil houbové ceremonie vedené mazatéckou šamankou Marií Sabinou. o svůj mimořádný zážitek se podělil v časopise Life v roce 1957 [3]. Albert Hoffmann, objevitel LSD, z těchto hub následně jako první izoloval psilocin a psilocybin, látky zodpovědné za psychoaktivní účinek [4].
Psilocybin patří mezi klasická psychedelika, v mozku tedy působí jako agonista serotoninových receptorů (5-HT2A) [5]. Agonismus těchto receptorů byl ve studiích na zvířatech spojen s rozšířením kognitivní flexibility [6], asociativním učením [7], kortikální neuronální plasticitou [8], neurogenezí (vznikem nových neuronů) [9] a antidepresivní odpovědí [10]. Nedávné klinické studie s psilocybinem na lidských subjektech přinesly velmi slibné předběžné výsledky v léčbě úzkosti u pacientů v terminálním stádiu rakoviny [11], obsedantně-kompulzivní poruchy [12] či závislostí [13, 14].
V posledních týdnech vyvolaly ve světových médiích rozruch výsledky aktuálního výzkumu britského týmu pod vedením neurovědce Dr. Robina Carharta-Harrise z Imperial College London. Tyto výsledky naznačují, že by psilocybin mohl představovat účinnou léčbu farmakorezistentních depresivních onemocnění, které na standardní léčbu nereagují [15]. Studie se zúčastnilo 12 pacientů, kteří trpěli středně těžkou až těžkou depresivní poruchou v průměru 17,8 let svého života. V tomto období podstoupili více neúspěšných léčebných zákroků, každý z nich vyzkoušel různé skupiny antidepresiv a s výjimkou jednoho subjektu i léčbu psychoterapií.
V rámci studie podstoupili pacienti dvě sezení s psilocybinem v podpůrném prostředí: s úvodní bezpečnostní (nízkou) dávkou 10 mg a následnou terapeutickou (vysokou) dávkou 25 mg v sedmidenním rozestupu. Sezením s psilocybinem předcházelo psychiatrické interview, vstupní měření baterií psychologických testů, měření pomocí funkční magnetické rezonance (fMRI) a přípravné psychologické sezení. v průběhu tohoto přípravného sezení byly pokusné osoby požádány, aby otevřeně mluvily o své osobní historii (včetně vlastních úvah o příčinách jejich deprese). Následně s nimi byly prodiskutovány možné psychologické účinky psilocybinu a proběhla simulace prvků sezení s aktivní látkou, jako například poslech ukázek hudby používané v sezeních s klapkami na očích.
Samotná sezení s psilocybinem probíhala v upravené místnosti s tlumeným světlem za neustále přítomnosti dvou asistentů, tzv. sitterů. Pacienti byli požádáni, aby se uvolnili na lůžku v poloze na zádech za doprovodu hudby přehrávané přes reproduktory a sluchátka. Sitteři se nacházeli po obou stranách lůžka a aplikovali nedirektivní podpůrný přístup, umožňující pacientům zažívat co nejvíce nerušenou „vnitřní cestu“.
Den po druhém psilocybinovém sezení následovalo opětovné měření psychologickými dotazníky a zobrazovací vyšetření mozku pomocí fMRI. Další opakovaná měření dotazníky se uskutečnila po 1, 2, 3 a 5 týdnech a poslední po 3 měsících od podání druhé dávky.
Akutní účinek psilocybinu byl dobře tolerovaný veškerými 12 pacienty a nevyskytly se žádné závažné nebo neočekávané vedlejší účinky. Nejčastějším vedlejším účinkem byla přechodná úzkost (většinou mírná) v období začátku působení účinku látky, kterou zažili všichni pacienti. Mezi další vedlejší účinky patřila přechodná zmatení a poruchy myšlení (9 pacientů), mírná nevolnost (4 pacienti) a přechodná bolest hlavy (4 pacienti). Všechny popsané dočasné projevy byly očekávanými účinky psilocybinu. Paranoidní prožívání se vyskytlo jenom u jednoho pacienta a bylo mírné a přechodné. Žádné trvalé psychotické příznaky nebyly pozorovány ani u jednoho z pacientů.
Po sezeních s psilocybinem nastalo u všech pacientů významné snížení příznaků deprese. Dle standardních posuzovacích kritérií týden po druhé dávce psilocybinu dosahovalo osm (67 %) z 12 pacientů plnou remisi (stav zcela bez deprese) a 3 měsíce od psychedelického sezení plnilo kritérium pro odpověď na léčbu (50% snížení skóre v Beckově škále deprese – BDI, v porovnání se vstupními hodnotami) stále sedm pacientů (58 %), z toho pět (42 %) stále zůstávalo v plné remisi. v porovnání se vstupními měřeními došlo u pacientů i k významnému poklesu úzkostlivosti (škála STAI-T) a anhedonie (škála SHAPS), přičemž rozdíly byly stále významné i 3 měsíce od druhé dávky psilocybinu.
Výsledky této studie poukázaly na to, že při dodržení náležitých postupů (pečlivý screening a adekvátní terapeutická podpora) je možné psilocybin bezpečně podat skupině pacientů s depresí. Rozsah a trvání snížení závažnosti symptomatiky podporuje legitimitu dalšího kontrolovaného výzkumu psilocybinu v léčbě deprese. Autoři jsou si vědomí limitů této pilotní studie vyplývajících z nízkého počtu subjektů a metodologického designu studie bez využití kontrolní skupiny (placebo) a dvojitě zaslepeného uspořádání. Klíčové otázky, na které by se podle výzkumníků měl další výzkum zaměřit, je vysvětlit, proč je pozorovaný terapeutický efekt tak velký a zda ho bude možné replikovat v metodologicky přísněji kontrolovaných studiích na větších vzorcích populace. Tato léčebná procedura se totiž neskládala pouze ze dvou dávek psilocybinu ale také z psychologické podpory před, v průběhu a následně po psychedelických sezeních. Tento vliv pozitivního terapeutického prostředí je v budoucích studiích nutno detailněji prozkoumat a kontrolovat.
Graf zveřejněný v rámci studie, který znázorňuje závažnost deprese (dle škály BDI) v čase u všech 12 jednotlivých pacientů, ukazuje další skutečnost, kterou však autoři studie v textu nezmiňují: příznaky deprese v průběhu 3měsíčního období po podaní druhé dávky psilocybinu u více než poloviny subjektů opětovně pozvolna narůstaly. Zdá se, že u těchto pacientů by bylo třeba dávku po 3 měsících opakovat. Navzdory tomu by však šlo o významný pokrok v léčbě v porovnání s každodenním užíváním antidepresiv, jejichž účinek se navíc dostavuje až po několika týdnech užívání (a například u těchto pacientů se dokonce nedostavil vůbec). Vzhledem k tomu, že po psychedelických sezeních nenásledovala žádná kontinuální psychoterapie, která by se zaměřovala na hlubší osobnostní změnu pacientů, bylo by možné pozvolný opětovný nárůst příznaků vysvětlit i opakováním nezpracovaných nevědomých vzorců fungování, které vedou k rozvoji deprese. Z tohoto důvodu by bylo zajímavé zaměřit se v dalších výzkumech na podání psilocybinu v kontextu dlouhodobější psychoterapie, která by mohla využít období dočasně zvýšené neuroplasticity po užití psilocybinu na dosažení hlubších osobnostních změn.

Zdroj: Carhart-Harris et al. 2016
Jaroslav Farkaš
Česká psychedelická společnost
Jazyková korektura: Vojtěch Viktorin, Jan Tichý
Zdroje:
1. Samorini, G. The oldest representations of hallucinogenic mushrooms in the world (Sahara Desert, 9000–7000 B.P.). Integration 1992; 2 (3): 69–78.
2. Hofmann A. Teonanácatl and Ololiuqui, two ancient magic drugs of Mexico. Bulletin on Narcotics 1971; 1: 3-14.
3. Wasson RG. Seeking the magic mushroom. Life 1957; May 13: 100–120.
4. Hofmann A, Frey A, Ott H, Petrzilka T, Troxler F. Konstitutionsaufklärung und Synthese von Psilocybin [The composition and synthesis of psilocybin]. Cellular and Molecular Life Sciences (in German) 1958; 14 (11): 397–399.
5. Tylš F. Neurobiologie psilocybinu ve vztahu k jeho potenciálnímu terapeutickému využití. Psychiatrie 2015; 19 (2): 104-112.
6. Boulougouris V, Glennon JC, Robbins TW. Dissociable effects of selective 5-HT2A and 5-HT2C receptor antagonists on serial spatial reversal learning in rats. Neuropsychopharmacology 2008; 33: 2007–19.
7. Harvey JA. Role of the serotonin 5-HT(2A) receptor in learning. Learn Mem 2003; 10: 355–62.
8. Vaidya VA, Marek GJ, Aghajanian GK, Duman RS. 5-HT2A receptor-mediated regulation of brain-derived neurotrophic factor mRNA in the hippocampus and the neocortex. J Neurosci 1997; 17 (8): 2785–95.
9. Catlow BJ, Song S, Paredes DA, Kirstein CL, Sanchez-Ramos J. Effects of psilocybin on hippocampal neurogenesis and extinction of trace fear conditioning. Exp Brain Res 2013; 228: 481-491.
10. Buchborn T, Schroder H, Hollt V, Grecksch G. Repeated lysergic acid diethylamide in an animal model of depression: normalisation of learning behaviour and hippocampal serotonin 5-HT2 signalling. J Psychopharmacol 2014; 28: 545–52.
11. Grob CS, Danforth AL, Chopra GS, et al. Pilot study of psilocybin treatment for anxiety in patients with advanced-stage cancer. Arch Gen Psychiatry 2011; 68: 71–78.
12. Moreno FA, Wiegand CB, Taitano EK, Delgado PL. Safety, tolerability, and efficacy of psilocybin in 9 patients with obsessive-compulsive disorder. J Clin Psychiatry 2006; 67: 1735–40.
13. Johnson MW, Garcia-Romeu A, Cosimano MP, Griffiths RR. Pilot study of the 5-HT2AR agonist psilocybin in the treatment of tobacco addiction. J Psychopharmacol 2014; 28: 983–92.
14. Bogenschutz MP, Forcehimes AA, Pommy JA, Wilcox CE, Barbosa P, Strassman RJ. Psilocybin-assisted treatment for alcohol dependence: a proof-of-concept study. J Psychopharmacol 2015; 29: 289–99.
15. Carhart-Harris, RL et al. Psilocybin with psychological support for treatment-resistant depression: an open-label feasibility study. Lancet Psychiatry 2016; Publikováno online 17. května 2016: http://dx.doi.org/10.1016/S2215-0366(16)30065-7.

 "Nejste v kondici." Vondráček to od Pekarové schytal už ve studiu. To byl jen začátek
"Nejste v kondici." Vondráček to od Pekarové schytal už ve studiu. To byl jen začátek Jak drahé bude máslo ve válce? To je otázka!
Jak drahé bude máslo ve válce? To je otázka! Fiala II slibuje platy jako v Německu, babišuje a trumpuje. Ale není Babiš ani Trump
Fiala II slibuje platy jako v Německu, babišuje a trumpuje. Ale není Babiš ani Trump Bezpodmínečná podpora Ukrajiny je klíč k míru. Američané to už pochopili
Bezpodmínečná podpora Ukrajiny je klíč k míru. Američané to už pochopili Klaus tvrdí, že se blížíme k 50. letům, k totalitě. Je to lež a nebezpečná manipulace
Klaus tvrdí, že se blížíme k 50. letům, k totalitě. Je to lež a nebezpečná manipulace

